実験中にはあらゆる副反応が想定されます。弊社ではご希望のペプチドがそれらにより難しそうでしたら、その理由と副反応を回避するべく、ペプチド配列等の変更の設計サービスをすることができます。
またステープルペプチドや安定同位体標識ペプチド、複雑なペプチドも含めそれらの設計サービスを提供することにより、従来合成することができなかったペプチドをお届けすることができます。
ペプチドの設計について
一般に、優れたペプチド抗原には次のような特性があります。タンパク質表面に位置し、らせん構造よりも柔軟な構造(通常はループ構造)、複雑でユニークな配列、翻訳後修飾部位や機能部位ではなく(抗体がそのような部位を認識することを目的としない限り)、合成が容易であることです。
しかし、これらの特性と抗原性の強さとの定量的な関係は明らかにされていません。
ペプチド抗原の設計は通常、二つの異なる方法で行われます。
- ペプチドの物理化学的特性を予測すること。
- 統計結果に基づいて予測を行うこと。
しかしどちら方法にも、タンパク質におけるペプチドの位置や二次構造、特定のターンなどの物理化学的特性を、高精度で予測することは困難ですので限界があります。
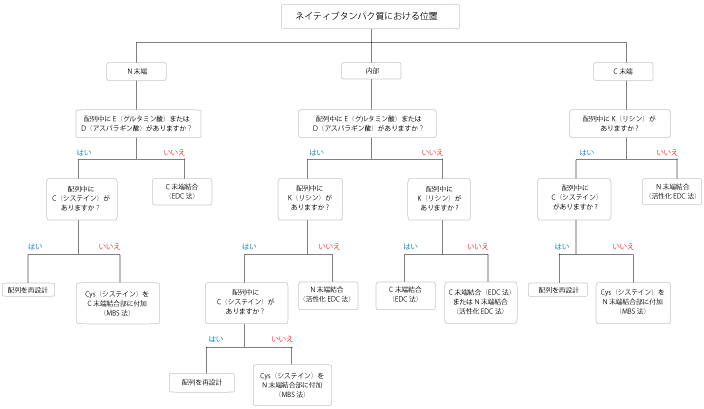
問題はタンパク質の折りたたみに関すること、もう一つは、ほとんどの場合で、溶液中の単離ペプチドがタンパク質のネイティブ構造を維持できないことです。
このことが既知の立体構造に基づき設計された抗原もまた、しばしば機能しない主な原因になります。システイン残基は担体タンパク質に架橋できるようにしばしばペプチドに付加されま すが、多くのシステイン残基と合成されるペプチドは扱いが困難な可能性があり、有用な抗体を得られない場合もあります。
例えば複数のシステイン残基が共有結合した凝集体の形成を引き起こしたり、タンパク質の高システイン領域ではいくつかのジスルフィド結合が形成されている場合があります。
従いまして還元型システインを含む直鎖ペプチドは、そのタンパク質自体を表現せず構造的に制約されます。要求されるペプチド抗原の多くは、長さが12~20残基の範囲で合成が比較的容易ですが、システイン残基をペプチド配列中に組み合わせることは避けてください。
アミノ酸の性質
| Amino Acid | Abbreviated name | Side Chain | Hydro-phobic | pKa | Polar | pH | Small | Tiny | Aromatic or Aliphatic | van der Walls Volume | |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Alanine | A | Ala | CH3 | X | – | – | – | X | X | – | 67 |
| Cysteine | C | Cys | -CH2SH | X | 8.18 | – | acidic | X | – | – | 86 |
| Aspartic acid | D | Asp | -CH2COOH | – | 3.9 | X | acidic | X | – | – | 91 |
| Glutamic acid | E | Glu | -CH2CH2COOH | – | 4.07 | X | acidic | – | – | – | 109 |
| Phenylalanine | F | Phe | -CH2C6H5 | X | – | – | – | – | – | Aromatic | 135 |
| Glycine | G | Gly | -H | X | – | – | – | X | X | – | 48 |
| Histidine | H | His | -CH2-C3H3N2 | – | 6.04 | X | weak basic | – | – | Aromatic | 118 |
| Isoleucine | I | Ile | -CH(CH3)CH2CH3 | X | – | – | – | – | – | Aliphatic | 124 |
| Lysine | K | Lys | -(CH2)4NH2 | – | 10.54 | X | basic | – | – | – | 135 |
| Leucine | L | Leu | -CH2CH(CH3)2 | X | – | – | – | – | – | Aliphatic | 124 |
| Methionine | M | Met | -CH2CH2SCH3 | X | – | – | – | – | – | – | 124 |
| Asparagine | N | Asn | -CH2CONH2 | – | – | X | – | X | – | – | 96 |
| Pyrrolysine | O | Pyl | |||||||||
| Proline | P | Pro | -CH2CH2CH2- | X | – | – | – | X | – | – | 90 |
| Glutamine | Q | Gln | -CH2CH2CONH2 | – | – | X | – | – | – | – | 114 |
| Arginine | R | Arg | -(CH2)3NH-C(NH)NH2 | – | 12.48 | X | strongly basic | – | – | – | 148 |
| Serine | S | Ser | -CH2OH | – | – | X | – | X | X | – | 73 |
| Threonine | T | Thr | -CH(OH)CH3 | – | – | X | weak acidic | X | – | – | 93 |
| Selenocysteine | U | Sec | -CH2SeH | X | 5.73 | – | – | X | – | – | |
| Valine | V | Val | -CH(CH3)2 | X | – | – | – | X | – | Aliphatic | 105 |
| Tryptophan | W | Trp | -CH2C8H6N | X | – | – | – | – | – | Aromatic | 163 |
| Tyrosine | Y | Tyr | -CH2-C6H4OH | – | 10.46 | X | – | – | – | Aromatic | 141 |
- 参考文献:
- 1, Peptide folding driven by Van der Waals interactions.
Protein Sci. 2015 Sep; 24(9): 1383–1388. Published online 2015 May 26. doi:10.1002/pro.2710. - 2, New descriptors of amino acids and their application to peptide QSAR study.
Peptides.2008 Oct;29(10):1798-805. doi: 10.1016/j.peptides.2008.06.004. Epub 2008 Jun 18. - 3, Comparison of van der Waals and semiempirical calculations of the molecular volumes of small molecules and proteins.
Biopolymers. 1997 Aug;42(2):191-202. - 4, An in silico platform for predicting, screening and designing of antihypertensive peptides.
Sci Rep.2015; 5: 12512.Published online 2015 Jul 27. doi: - 10.1038/srep12512. PMCID: PMC4515604.

 082-223-6347
082-223-6347